
一种使用微流控装置中水凝胶图案化来模拟骨软骨界面的局部缺氧环境。
Introduction
关节中骨与软骨之间的骨软骨界面是人体中最普遍的组织界面之一。许多关节疾病如骨关节炎(Osteoarthritis,OA))都涉及该组织界面上骨-软骨串扰失调,因此在临床上具有重要意义。因此,通过在细胞外基质(ECM)中建立骨细胞-软骨细胞共培养物,并对基质的硬度、孔隙率、表面和生化线索进行局部控制,对骨软骨界面进行工程化改造的工作一直在广泛开展。 维持生理氧浓度对体外培养的软骨细胞和成骨细胞维持其组织特异性表型和功能非常重要。对形成透明软骨非常重要的软骨细胞合成代谢在低氧环境下会增强,而在常氧环境下则会受到抑制。相反,骨组织暴露在低氧浓度下时,骨矿化和再生会受到抑制。因此,有必要在工程骨软骨组织模型中局部控制氧浓度,以再现正常或疾病条件下骨与软骨之间的生理相关串扰。
细胞培养箱中氧气浓度的传统控制方法,只有一种预设浓度(如缺氧条件为5%,常氧条件为20%),因此无法模拟骨软骨界面上氧气浓度的差异。目前已开发出微流控设备,通过设计通道网络直接流动气体或化学还原剂,并用透气膜将其与培养基隔开,从而在细胞培养物中产生氧浓度梯度。气体或化学还原剂与培养基之间的平衡会导致培养基中溶解氧的减少。这种灌注装置增加了体外组织构建体的工程复杂性,限制了它们在常规生物实验室中的实际应用和放大。
为了克服这一局限性,作者认为使用水凝胶等可图案化的固体可以提供一种简单、可扩展的方法,在空间上控制氧清除剂的输送,从而产生局部缺氧环境,再现骨软骨组织界面的不同氧环境。这种水凝胶不需要任何交联,因为它是通过可逆氢键结合在一起的。因此,没有破坏培养基中氧清除剂或其他可溶性因子的风险。在这里展示了在微流控设备中对含氧清除剂的颗粒状水凝胶(以下简称缺氧水凝胶)进行图案化的可行性,以再现骨软骨界面上存在的不同缺氧和正常缺氧条件。研究表明,在不同氧含量条件下维持的微流控骨关节共培养模型可以再现与OA病理生理学相关的骨-软骨串扰。
Generation of Hypoxic Hydrogels for Controlling Oxygen Concentration
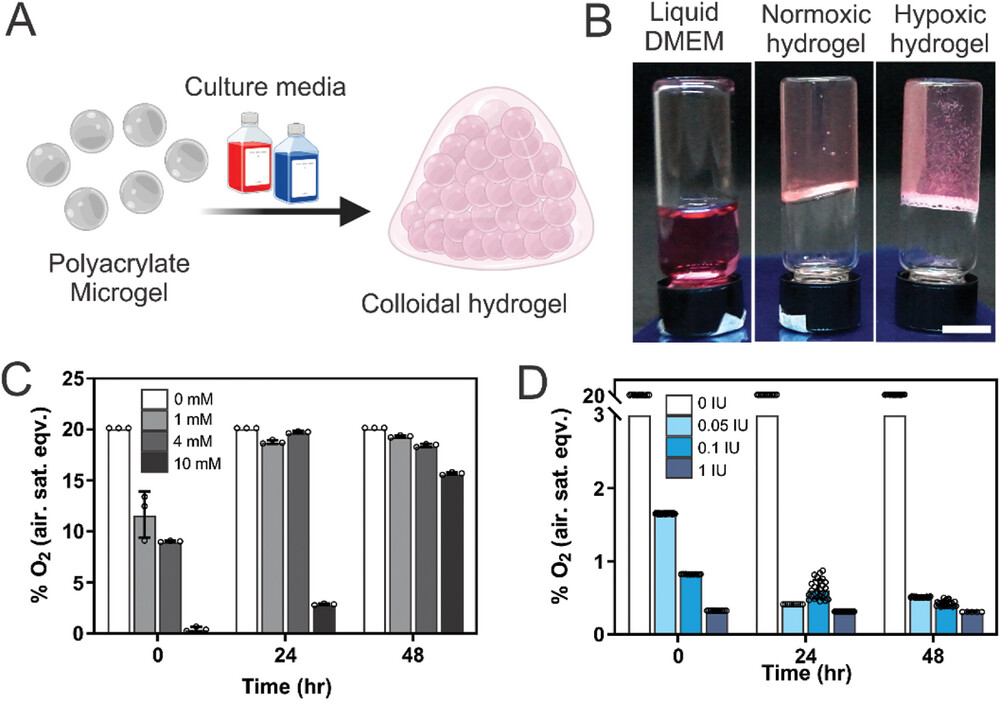
- (A)聚丙烯酸酯微凝胶在液体培养基中膨胀并堵塞后形成颗粒状水凝胶的示意图。
- (B)显示成功形成缺氧(DMEM + 氧清除剂)和常氧(仅DMEM)颗粒状水凝胶的照片。
- (C-D)含(C)亚硫酸钠或(D)氧化酶作为氧清除剂的颗粒状水凝胶中的氧浓度。
Patterning Differential Oxygen Environments with Hypoxic Hydrogels
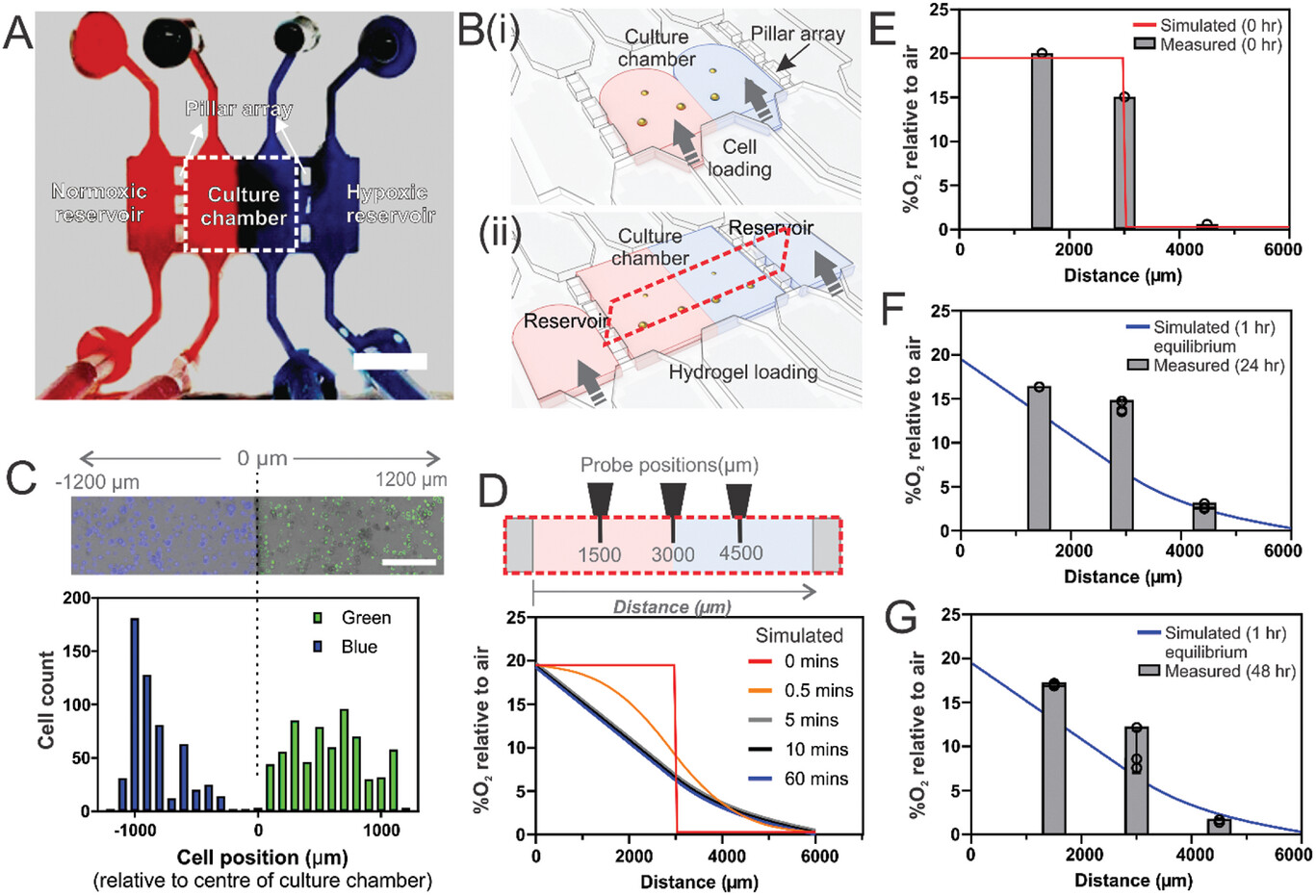
- (A)微流控装置的特点是中央有一个细胞培养室,两侧有两个储液室,并由微柱阵列隔开。这种设计允许(i)细胞在常氧(红色表示)和缺氧(蓝色表示)水凝胶双流中层流播种,以及(ii)通过更换储液室中的水凝胶补充营养,所有这些操作都能将干扰降到最低。
- (B) 细胞培养室的横截面示意图显示:(i) 用蓝色和绿色荧光标记的细胞图案;(ii) 氧传感探针的位置。
- (C)柱状图量化了蓝色和绿色标记细胞在整个细胞培养室宽度上的分布情况,同时注意到细胞培养室界面(装置内标注为0 μm)上的细胞混合极少。
- (D)计算模拟揭示了使用常氧和缺氧水凝胶进行图案化后氧气梯度建立的时间依赖性。
- (E-G)实验测量了细胞培养室中三个不同位置的氧气浓度(详见 B、ii),显示的是在37°C、5% CO2条件下培养后的不同时间点:(E)0 h、(F)24 h和(G)48 h。
Chondrocyte Cellular Responses in Hypoxic Hydrogels
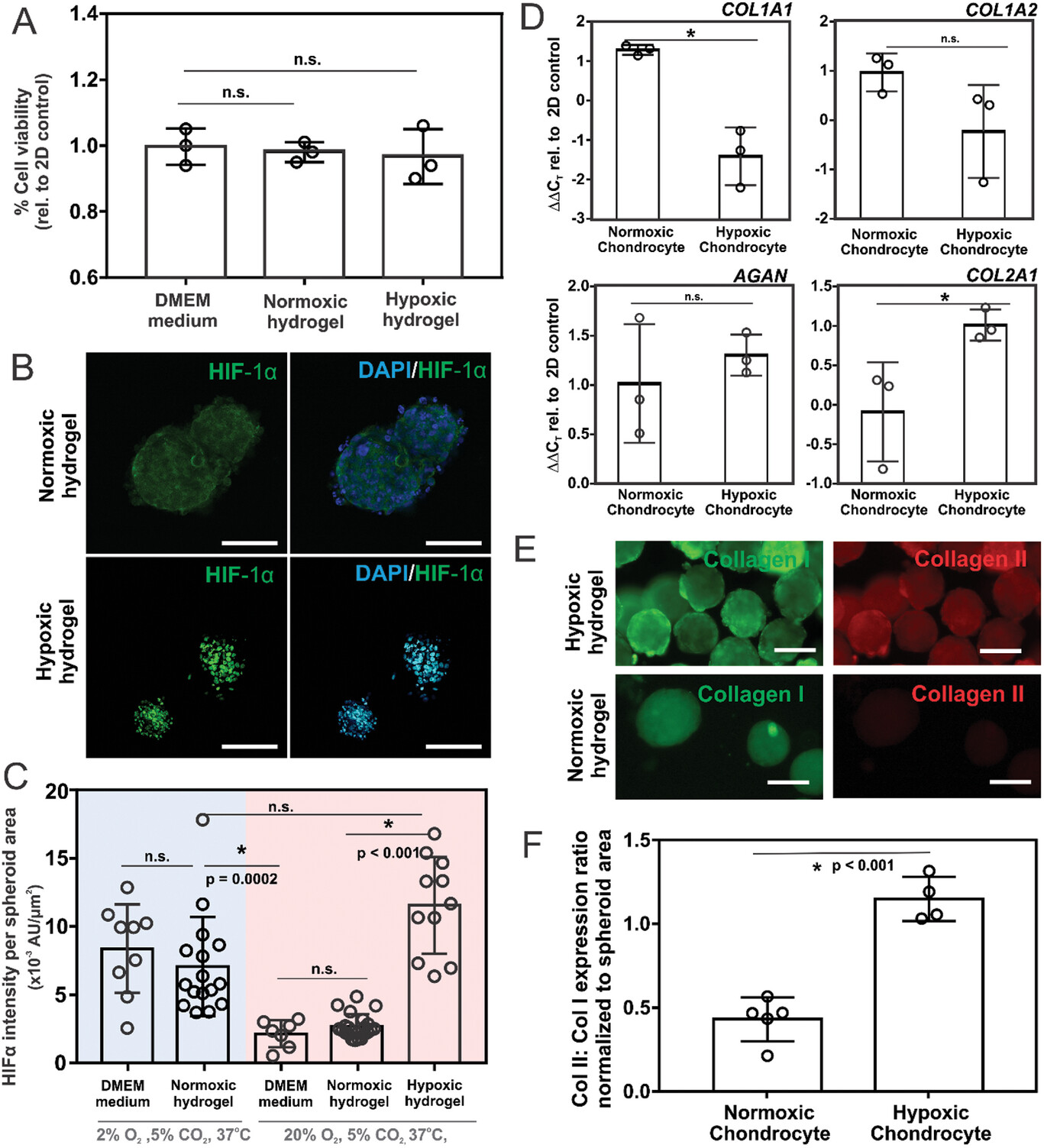
- (A)在液体培养基、常氧和低氧水凝胶中培养4 d的原代人类软骨细胞球的活力测定。
- (B)在常氧和低氧水凝胶环境中培养4 d后,软骨细胞球内HIF-1α表达的免疫荧光显现。
- (C)在常规(20% O2,5% CO2)或低氧(2% O2,5% CO2)培养箱条件下,在液体DMEM培养基、常氧和低氧水凝胶中培养的软骨细胞中HIF-1α表达水平的定量分析。表明可以在不需要低氧培养箱的情况下引发低氧细胞反应。
- (D)软骨细胞在氧气含量<5%的低氧环境中培养时表现出更多的生理相关表型。这里是在常氧和缺氧水凝胶中培养4 d后,COL1A1、COL1A2、AGAN和COL2A1的基因表达谱。 其中纤维软骨(COL1A1、COL1A2)表达降低,透明软骨(AGAN、COL2A1 )表达升高。
- (E)低氧培养条件会增加II型胶原蛋白的表达,从而产生与透明软骨相关的更多合成代谢表型。另一方面,含氧量正常的培养条件有利于I型胶原蛋白的产生,从而导致与纤维软骨相关的更多分解代谢表型。I型(绿色)和II型(红色)胶原蛋白在常氧和缺氧水凝胶中4 d后的免疫荧光成像。
- (F)软骨细胞球体内II型胶原与I型胶原表达相对强度的定量比较。
Osteoblast-Chondrocyte Coculture Under Differential Oxygen Tension
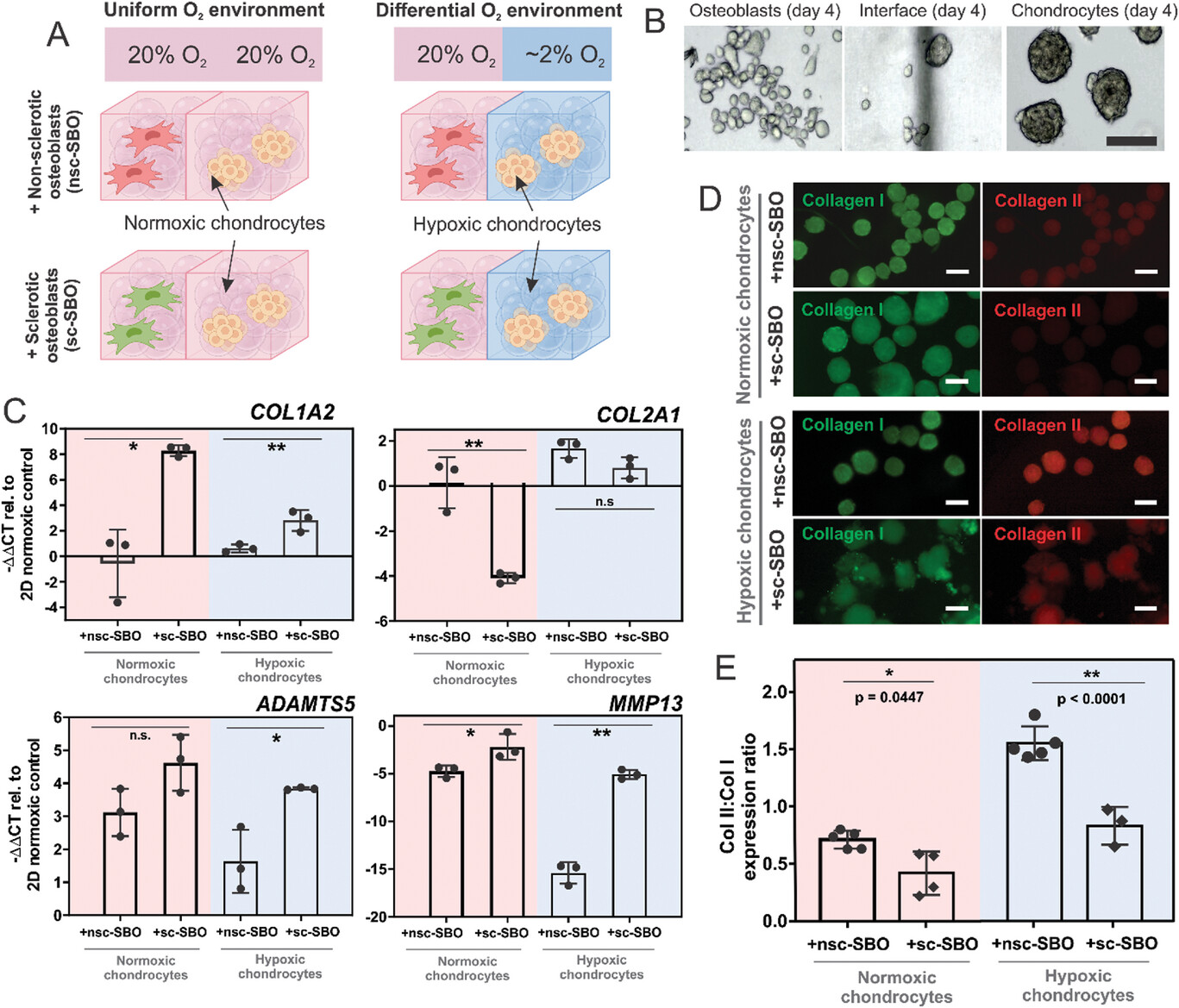
- (A)实验设计说明软骨细胞在不同氧气条件下与非硬化 (nsc-SBO) 和硬化 (sc-SBO) 成骨细胞配对。
- (B) 第4 d的光学显微镜图像显示分别嵌入常氧和低氧水凝胶中的共培养成骨细胞和软骨细胞球。
- (C)在均匀和差异O2共培养物中对COL1A2、COL2A1、ADAMTS5 和MMP13基因表达进行RT-qPCR分析。 研究结果表明,在差异氧共培养和均匀氧共培养中, 软骨细胞与sc-SBO共培养使I型胶原 ( COL1A2 )的表达分别显著增加了14.97 倍和 4.87 倍。相反,sc-SBO减弱了II型胶原 ( COL2A1 )的表达,尽管与差异氧共培养(2.06 倍)相比,均匀氧共培养(29.29 倍)中的减少更为显著。sc-SBOs对软骨细胞的影响在差异氧环境下诱导分解代谢酶方面更为明显。具体来说,ADAMTS5 (一种聚集蛋白聚糖酶)在均匀氧共培养中上调了1.48 倍(p = 0.133),而在不同氧水平下共培养则显示出显著的2.35 倍上调(p = 0.026) 。胶原酶MMP13也观察到类似的趋势,其中均匀氧共培养物表现出2.14倍的上调(p = 0.046),而具有差异氧水平的共培养物则表现出3.01倍的上调。
- (D)免疫组织化学染色描绘了与nsc-SBO和sc-SBO均匀和差异O2共培养物中软骨细胞中的I型(绿色)和II型(红色)胶原蛋白。在蛋白质水平上检测 sc-SBO 诱导的软骨基质分解代谢,当软骨细胞球体与nsc-SBO或sc-SBO在均匀或差异氧水平下共培养时,确定软骨细胞球体中II型与I型胶原的相对量(Col II / Col I 比率)。在与sc-SBO共培养中,观察到Col II / Col I比率显著降低,大约比nsc-SBO共培养低两倍,无论氧气条件如何。这种变化在氧气水平不同的情况下更为明显,软骨细胞中 II 型与 I 型胶原蛋白的比例本质上较高,这与早期的发现一致,即缺氧条件促进II型胶原蛋白的产生。通过评估成骨细胞分化标记物、碱性磷酸酶( ALP)和骨桥蛋白(SSP1)的表达,评估了共培养中不同氧水平对nsc-SBO和sc-SBO的影响。无论氧气条件如何, nsc-SBO 中的ALP和SSP1表达以及 sc-SBO 中的ALP表达均未观察到显着差异。略有增加在缺氧条件下,sc-SBO 中观察到SSP1表达。结果表明,氧气水平对成骨细胞表型的影响有限。
- (E)软骨细胞中II型:I型胶原蛋白的强度定量。综上所述,结果强调了sc-SBO对软骨细胞胶原蛋白合成的影响,并且分解代谢酶的表达受到氧气条件的调节。这表明氧水平在调节成骨细胞-软骨细胞串扰以诱导软骨细胞分解代谢表型中具有潜在作用。
Differential Oxygen Level Mimics Physiological Changes in Chondrocyte Metabolism Induced by Sclerotic Subchondral Osteoblasts
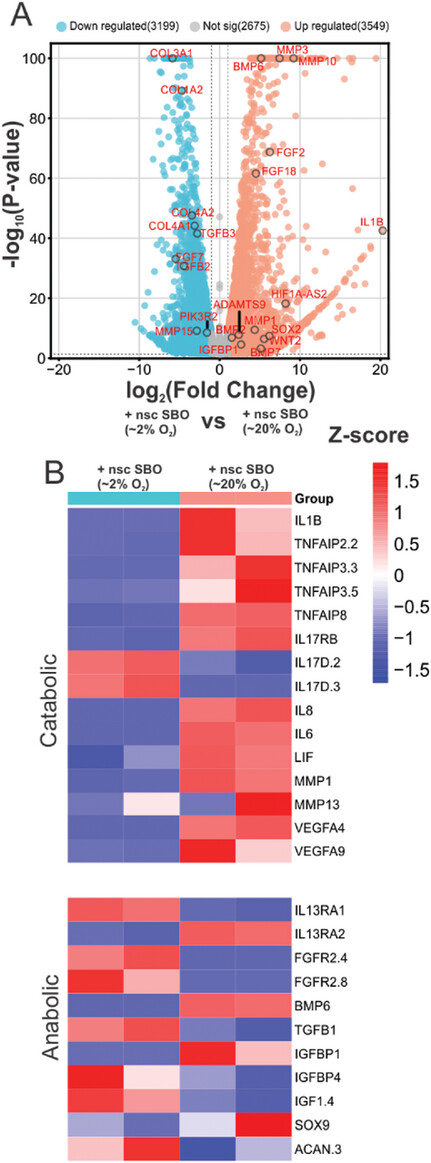
- (A)与nsc-SBO共培养的低氧和常氧软骨细胞之间DEG的火山图。注释基因(红色)与软骨细胞软骨发育相关。
- (B)与nsc-SBO共培养的缺氧和常氧软骨细胞的软骨代谢涉及的DEG热图。
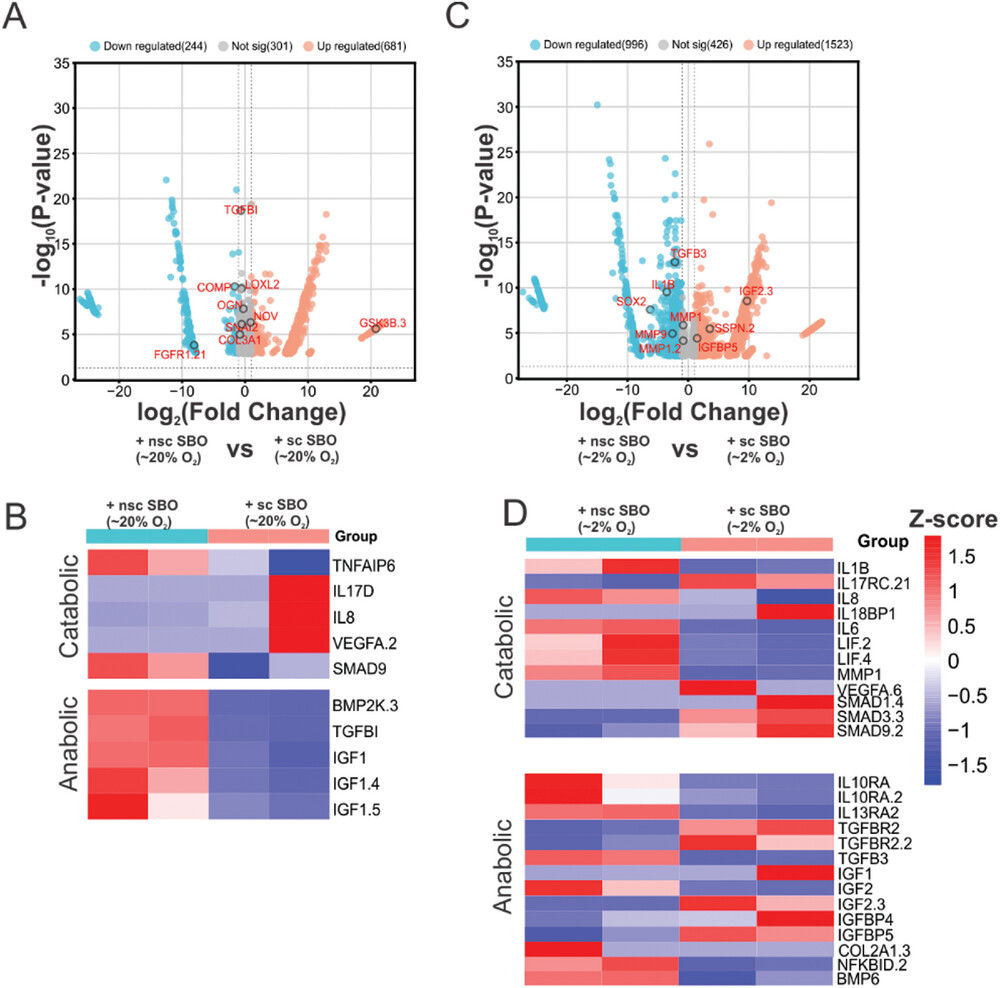
- (A)DEG常氧软骨细胞与nsc-SBO和sc-SBO共培养的火山图,其中标记了与常氧条件下软骨发育相关的基因
- (B)常氧软骨细胞与nsc-SBO共培养的软骨代谢中DEG的热图。
- (C)DEG常氧软骨细胞与nsc-SBO和sc-SBO共培养的火山图,并带有与缺氧条件下软骨发育相关的标记基因。
- (D)缺氧软骨细胞与nsc-SBO共培养的软骨代谢中DEG的热图。这些结果与之前对从OA患者获得的原代软骨组织和软骨细胞中分析这些因素的研究结果一致。证明该系统有效地模拟了sc-SBO诱导的软骨细胞分解代谢和合成代谢的变化,这是在均匀常氧共培养中未见的结果。
Conclusion
- 展示了一种使用功能材料方法在共培养物中模拟差异氧微环境的简便方法。由聚丙烯酸酯微凝胶在除氧剂中溶胀形成的颗粒状水凝胶可用作功能材料,对细胞培养物的氧气微环境进行时空控制,而不需要专门的仪器。
- 这种功能材料可以合并到微流体装置中,利用骨软骨界面处发生的生理差异氧梯度来模拟人类原代成骨细胞和软骨细胞。与统一的常氧共培养模型相比,这使得共培养模型能够更大程度地概括涉及软骨细胞代谢、基质合成和降解的分子相互作用。
Reference
Ong L J Y, Sun A R, Wang Z, et al. Localized Oxygen Control in a Microfluidic Osteochondral Interface Model Recapitulates Bone–Cartilage Crosstalk During Osteoarthritis[J]. Advanced Functional Materials, 2024: 2315608.



